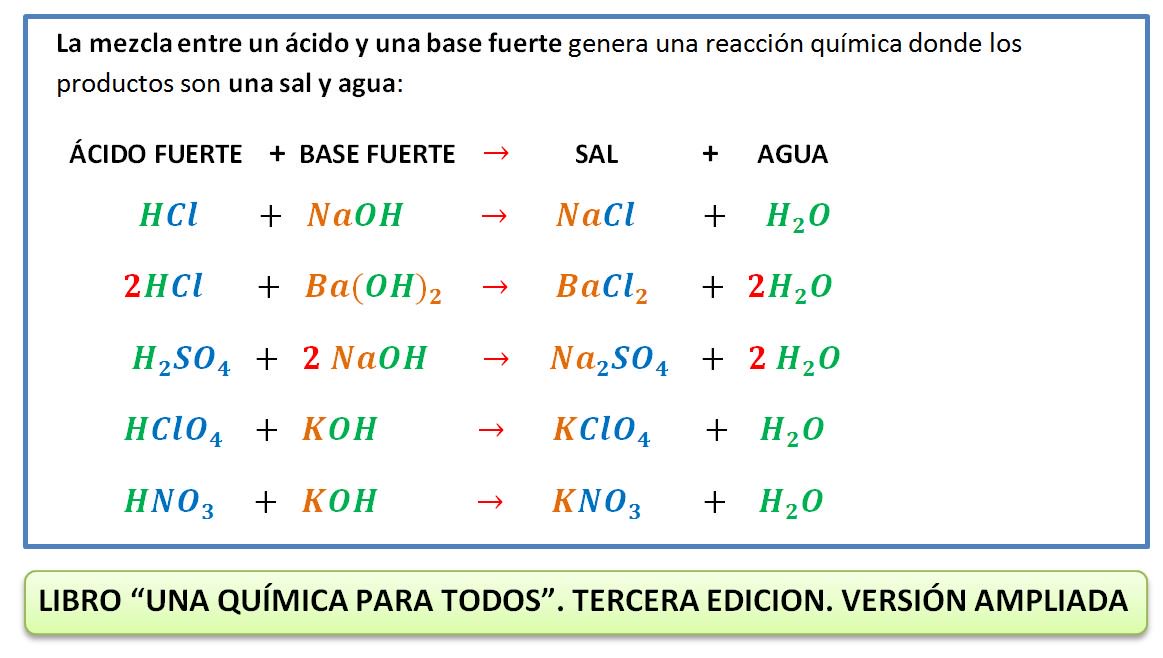
La volumetría ácido-base es una técnica que permite calcular la concentración de un ácido (o de una base) disueltos, haciendo reaccionar un volumen del mismo con otro volumen de una disolución básica (o ácida) de concentración conocida.
Para realizar la valoración se mezclan gradualmente el ácido y la base en presencia de un indicador que muestra el momento en que se puede dar por finalizada la reacción de valoración. Entre estos sistemas están aquellos que utilizan indicadores coloreados, los cuales son compuestos orgánicos que se adicionan a la disolución y cambian de color según el pH del medio (zona de viraje).
Este punto se denomina punto de equivalencia de la valoración, y dicho punto equivale al momento en que se igualan estequiometricamente las cantidades de ácido y base. Dicho punto se detecta fácilmente porque en sus inmediaciones se produce un brusco salto de pH que se puede detectar con un pH-metro o con un indicador.
Por tanto, es deseable que la zona de viraje abarque el pH correspondiente al punto de equivalencia (momento en que se ha adicionado la cantidad de moles de ácido necesaria para que reaccionen totalmente con la base).
El pH correspondiente al punto de equivalencia depende de las fuerzas de las especies que se valoran. Así, se tiene:
1. Si se valora un ácido fuerte con una base fuerte o viceversa, el pH es neutro. En este caso, se usan indicadores cuyas zonas de virajes están situadas entre 4 ≤ pH ≤ 9.
2. Si se valora un ácido débil con una base fuerte, el pH es básico (pH > 7). Por tanto, el indicador que se emplee debe tener en medio básico su zona de viraje, pYara que el punto final coincida sin mucho error con el punto de equivalencia.
3.Si se valora una base débil con un ácido fuerte, el pH es ácido (pH < 7). Como en el caso anterior, pero en la zona ácida.
Fórmula del pto. de equivalencia, de la cual deducimos que en dicho pto. se igualan estequiométricamente las cantidades de ácido y base.
nácido = nbase ó lo que es lo mismo.
M ácido. V ácido = M base. V base
Vamos a ver un Ejemplo del tipo 2. (Valoración ácido débil con base fuerte) y vamos comprobar que el pH será básico después del punto de equivalencia.
Suponemos que partimos de ácido acético (ácido débil) y valoramos con NaOH (base fuerte), por lo tanto obtendremos acetato de sodio en el punto de equivalencia cuyo pH será básico
Si nos fijamos en la imagen anterior una vez el pH lo vamos a calcular siguiendo varios pasos, en el 1º hemos igualado en el punto de equivalencia el nº moles de ácido con el nº moles de base para conocer el V de base que hemos gastado en llegar al pto. de equivalencia para después averiguar su concentración.
En el 2º paso será una vez averiguada la concentración de la base, calcular el pH correspondiente a la hidrólisis de la sal formada. Como en este caso solamente sufre hidrólisis el ión acetato el pH se calculará:
Os dejo el vídeo explicativo para su mejor compresión:
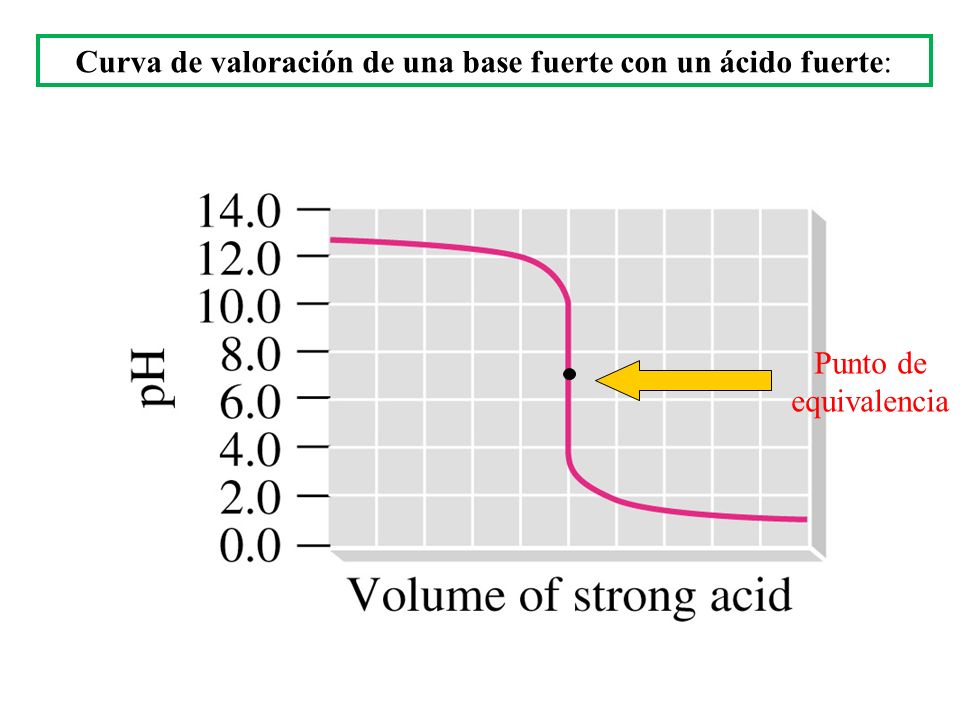
6.1 CURVAS DE VALORACIÓN
Son representaciones en diagramas cartesianos de los procesos de valoración.
A continuación os dejo la correspondiente a la valoración de ác fuerte con base fuerte. Donde veréis que el pH del pto de equivalencia es 7 puesto que la sal formada no sufre hidrólisis por proceder sus iones conjugados de especies fuertes.
En este caso como Indicador podemos elegir Azul de bomotimol ya que su intervalo de viraje está entre pH = 6-7.6 (podéis repasar la entrada del Blog de indicadores)
La valoración más común es la que se hace con un ácido débil(por ejemplo ac acético) y una base fuerte(por ejemplo sosa), utilizando como indicador la fenolftaleína cuyo pH de viraje = 8-10. Se elige este indicador porque el pH resultante será básico, puesto que el acetato sufre hidrólisis. Como veis la cantidad necesaria de NaOH que hemos añadido es 25 mL, con este dato podremos calcular su concentración y con ello el pH de forma matemática. (Pues en la práctica se mide con un pHmetro)
A continuación os dejo una imagen del libro con problemas resueltos y con los ejercicios que vienen más abajo y debéis resolver el 1 y 2 para calcular la concentración del ácido o base que hemos valorado.
También quiero que busquéis una Entrada del Blog que se llama mi presentación slide valoración ácido base, que está publicada en 2012, pues es la práctica de Laboratorio virtual que vamos hacer.




Este comentario ha sido eliminado por el autor.
ResponderEliminarno, estos son los resultados
Eliminar1. 1g
2. 0.25M
A mí me da el 3. 0.3M y el 4. 5ml
ResponderEliminarno, en el 3 sale 0.6 M y en el 4 20 ml. La sal que se forma en el 3 es sulfato de sodio, por eso hay que ajustar la reacción y considerar la estequiometría. Estos los repasaremos el viernes por zoom
Eliminar