Al igual que en el Tema de Equilibrio hablábamos de grado de disociación, en este caso, el grado de ionización (ɑ) se define como la fracción de moléculas disociadas o ionizadas respecto a las iniciales; como veis es un concepto similar que se utilizará solamente para ácidos y bases débiles puesto que los fuertes se disocian completamente:
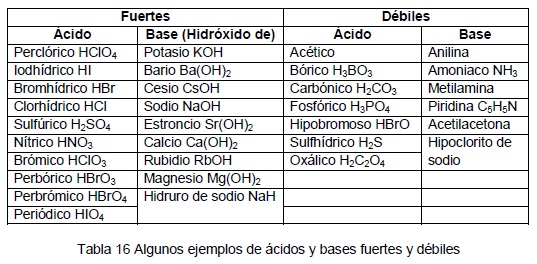
A continuación os dejo un listado de ácidos y bases fuertes y débiles:
y un segundo listado donde se relacionan con su Ka o su Kb, ya sabéis cuando > sea la K > fortaleza tendrá el ácido o la base, como orientación deciros que a partir de 10-5 ya son débiles; también tener en cuenta que cuanto más fuerte es un ácido más débil es su base conjugada, puesto que son términos opuestos.
Ejercicio 1: Aplicando la teoría de Bronsted Lowry en disoclución acuosa: a) Razona si las especies amonio e ión sulfuro son ácidos o bases. b) Justifica cuáles son las bases conjugadas de los ácidos HCN y C6H5COOH c) Sabiendo que a 25ºC las Ka de dichos ácidos son 6,4.10-5 y 4,9.10-10 , respectívamente ¿qué base conjugada será más fuerte?. Justifica la respuesta
Ejercicio 2: Ordena de mayor a menor fuerza los acidos HCO3-, HF, HNO3 y H3O+ y las bases NH3, HCO3- , HS- y OH-
Ejercicio 3: Considerando el vinagre una disolución de ácido acético en agua de concentración 0.9 M, determina el grado de ionización del ácido acético en el vinagre. Datos: Ka CH3COOH = 1,78.10-5
Ayúdate, con este video de resolución de un problema similar: (se resuelven igual que los de eq, haciendo en primer lugar el balance). Más videos: https://youtu.be/QBRrj34Joeo
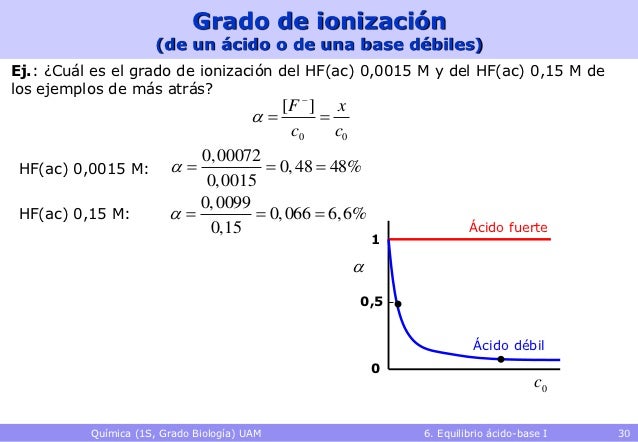

Chicos en el ejercicio 3, os tiene que salir un grado de ionización de 4,44.10-3
ResponderEliminarRevisados los ejercicios que me habéis mandado la mayoría están correctos, simplemente debéis tener cuidado con los conceptos ácido(cede H+ o iones hidronio al medio como el NH4+ pero no vale escribir p+) y base (acepta H+ del medio como el S2-del ejercicio 1). Solamente pueden ser ácidos y bases las sustancias anfóteras como el agua o el ión hidrogenocarbonato. Cuidado con las ionizaciones, comprobar que hay electroneutralidad, y en el último apartado del ejercicio 1 podéis hayar la Kb de su base conjugada utilizando la expresión Kw = Ka.kb para justificar la respuesta
ResponderEliminarEste comentario ha sido eliminado por el autor.
ResponderEliminar